Les atomes sont des particules qui composent la matière. Ils sont constitués d’un noyau composé de nucléons pouvant être des protons chargés positivement ou des neutrons électriquement neutres, ainsi que d’électrons qui forment un nuage autour du noyau.
Deux atomes sont dits isotopes lorsqu’ils ont le même nombre de protons mais un nombre de neutrons différent. Leur masse change, mais leurs propriétés chimiques restent les mêmes.
Ils sont souvent associés afin de devenir stables. Cette association forme une molécule.
Par exemple, la molécule d’eau possède quatre formes isotopiques stables relativement fréquentes :
- H216O où l’atome d’oxygène central et les deux atomes d’hydrogène sont sous leur forme isotopique la plus commune et la plus légère
- H218O où l’atome d’oxygène central est dans sa forme isotopique stable la plus lourde
- HD16O où un des deux atomes d’hydrogène est sous la forme isotopique lourde D (masse 2 g/mol)
- H217O où l’atome d’oxygène central est dans une forme isotopique stable intermédiaire de masse 17g/mol
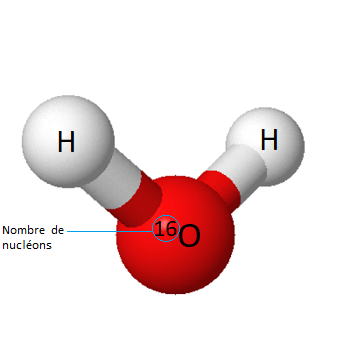
Représentation d’une molécule légère d’eau
Le pourcentage de la molécule d’eau H218O par rapport à H216O est de l’ordre de 0,2 tandis que celui de la molécule HD16O est de l’ordre de 0,015%.
| Elément | Isotopes | Abondance relative (%) |
| Hydrogène | 1H 2H(ou D) | 99,985 0,016 |
| Oxygène | 16O 17O 18O | 99,759 0,037 0,201 |
